Współczesne podejście do zapobiegania i leczenia kandydozy jamy ustnej – wykorzystanie preparatów firmy Curasept
Materiały i metoda
Organizmy i warunki wzrostu
W badaniach wykorzystano cztery szczepy wzorcowe grzybów z rodzaju Candida, reprezentujące te, które najczęściej powodują drożdżycę błony śluzowej jamy ustnej. Szczepy pochodziły z kolekcji ATCC (ang. American Type Culture Collection): Candida albicans ATCC 10231, Candida parapsilosis ATCC 22019, Candida tropicalis ATCC 66029 i Candida kefyr ATCC 2512 i należą do banku szczepów Katedry i Zakładu Mikrobiologii i Wirusologii Wydziału Nauk Farmaceutycznych w Sosnowcu. Przechowywane były w temperaturze -80°C, w bulionie tryptozowo-sojowym z dodatkiem glicerolu. W celu namnożenia i sprawdzenia czystości poszczególne szczepy przesiano na szalkę Petriego z agarem wzbogaconym 5-proc. odwłóknioną krwią baranią oraz podłożem Sabourauda z chloramfenikolem. Po 24-godzinnej inkubacji w cieplarce laboratoryjnej, w 37°C, w warunkach tlenowych, z podłoża Sabourauda z chloramfenikolem pobrano próbki wyrosłych kolonii i wykonano, dodając jałowy roztwór soli fizjologicznej, zawiesinę o gęstości 0,5 w skali McFarlanda. Gęstość oceniano spektrofotometrycznie. Następnie 1 ml tak przygotowanej zawiesiny (dla każdego szczepu) sterylną pipetą naniesiono na powierzchnię stałego podłoża Sabourauda z chloramfenikolem i równomiernie rozprowadzono po całej jej powierzchni. Przygotowano 8 sztuk takich szalek, po 2 dla każdego badanego szczepu. Szalkę Petriego, na jej szklanej części, podzielono flamastrem na 4 równe fragmenty. Tak przygotowane płytki umieszczono w cieplarce.
Oceniane substancje
W celu sprawdzenia działania przeciwgrzybiczego w badaniu wykorzystano trzy substancje o konsystencji żelu do zastosowania klinicznego w stomatologii firmy Curasept (Saronno, Włochy). Żel PREVENT – zawierający w swoim składzie ozonowaną oliwę z oliwek, olejek z drzewa herbacianego, colostrum i stevię; żel PERIODONTAL GEL ADS 100 – zawierający dwuglukonian chlorheksydyny w stężeniu 1% oraz żel PERIODONTAL GEL ADS 350 − zawierający dwuglukonian chlorheksydyny w stężeniu 0,5%.
Grupy badane i kontrolne
Do badania przygotowano także 96 sterylnych krążków bibuły o średnicy 5 mm. Podzielono je po 24 dla każdego szczepu, po 12 na każdą z szalek, po 3 na każde z 4 wyróżnionych pól.
Sprawdź inne artykuły z kategorii PERIODONTOLOGIA.
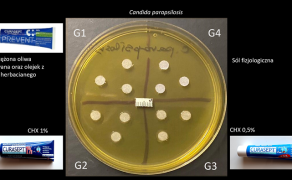
Po 6 h inkubacji w cieplarce wyjęto wszystkie szalki Petriego z niewidocznymi jeszcze wyrosłymi koloniami drożdży, a następnie na każdej z nich wyodrębniono trzy grupy badane i grupę kontrolną (fot. 1).
Grupy badane:
• G1 – trzy krążki bibuły nasączano żelem PREVENT przez 1 min aż do uzyskania jednorodnej na całej powierzchni zmiany koloru krążka. Następnie usunięto nadmiar żelu oraz umieszczono je w lewej, górnej ćwiartce szalki,
• G2 – trzy krążki bibuły nasączano 1-proc. żelem Periodontal Gel ADS 100 i umieszczono w lewej, dolnej ćwiartce,
• G3 – trzy krążki bibuły nasączano 0,5-proc. żelem Periodontal Gel ADS 350 i umieszczono w dolnej, prawej ćwiartce,
• G4 – grupa kontrolna – trzy krążki bibuły nasączone roztworem soli fizjologicznej (NaCl 0,9% B.Braun, Melsungen, Niemcy) umieszczono w górnej, prawej ćwiartce płytki Petriego.
Na środku każdej płytki umieszczono także jałowy 1-centymetrowy fragment miarki w celu możliwości oceny wielkości przyszłej średnicy strefy zahamowania wzrostu drożdży na podstawie dokumentacji fotograficznej wykonanej do badania. Bezpośrednio po nałożeniu krążków wszystkie przygotowane płytki Petriego umieszczono w cieplarce laboratoryjnej MIR-262 SANYO (Etten-Leur, Holandia) i inkubowano w standardowych warunkach tlenowych. Po upływie 24, 48, 72, 96, 120 h inkubacji płytki wyjmowano z cieplarki i fotografowano aparatem DMC-G80 Lumix Panasonic (Osaka, Japonia) z obiektywem Lumix Panasonic H-FS 2060 12-60 micro-HD (Osaka, Japonia), z odległości 30 cm. Aparat zamontowano na statywie.