Ocena wpływu wybranych substancji pomocniczych na działanie dezynfekcyjne diglukonianu chlorheksydyny
- Jaki jest najskuteczniejszy i najbezpieczniejszy środek przeciwbakteryjny?
- Porównanie działania bakteriobójczego i grzybobójczego gotowych płukanek z CHG?
- Skuteczność dezynfekcyjna trzech płukanek.
Title: Evaluation of the influence of selected excipients on the disinfection activity of chlorhexidine digluconate
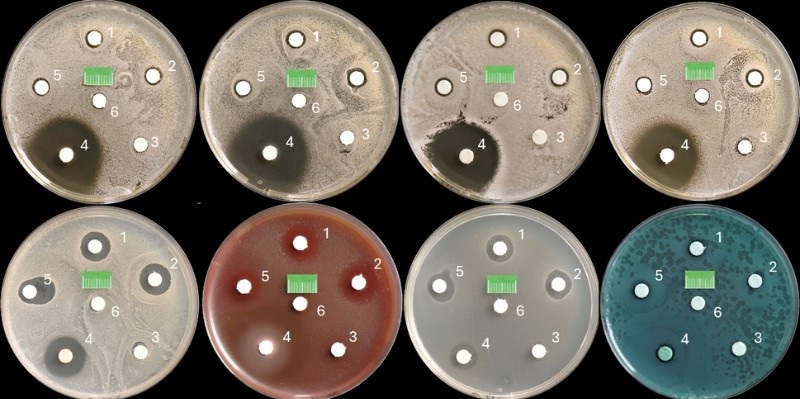
Streszczenie: Diglukonian chlorheksydyny (CHG) jest uważany za najskuteczniejszy i najbezpieczniejszy środek przeciwbakteryjny stosowany w stomatologii, ale dodatki substancji pomocniczych w preparatach złożonych mogą zmieniać ten stan. Dlatego celem badania było porównanie działania bakteriobójczego i grzybobójczego gotowych złożonych płukanek z CHG i ich poszczególnych substancji składowych na wybrane szczepy wzorcowe. Badania wykonano metodą dyfuzyjno-krążkową z wykorzystaniem szczepów wzorcowych bakterii Staphylococcus aureus, Streptococcus pyogenes, Enterococcus faecalis, Pseudomonas aeruginosa oraz drożdży C. albicans, C. glabrata, C. krusei, C. parapsilosis. Oceniono skuteczność [...]